Buenos días Carbonian@s,
Hace unas semanas celebramos el #DiaMundialdelCancer o #WorldCancerDay, y aprovechando ese evento varios medios de comunicación se hicieron eco de un “nuevo” tratamiento con un nombre un tanto peculiar: células CAR-T.
Desde este #UltimaHora en el que nos informaban que los primeros pacientes que recibieron esa terapia cumplían 10 años curados, hasta su definición como “la terapia del futuro”, pasando por la presentación de “un método revolucionario”, estuvimos todo el día oyendo hablar de CAR-T. Y, por si fuera poco, si visteis las noticias mientras cenabais pudisteis conocer a José Antonio, un paciente con mieloma múltiple tratado así en el 12 de Octubre que se sentía como un X-Men. Os invito a volver a ver la noticia aquí.
Pero, ¿qué son las terapias CAR-T?
Estructura y funcionamiento de los CAR-T
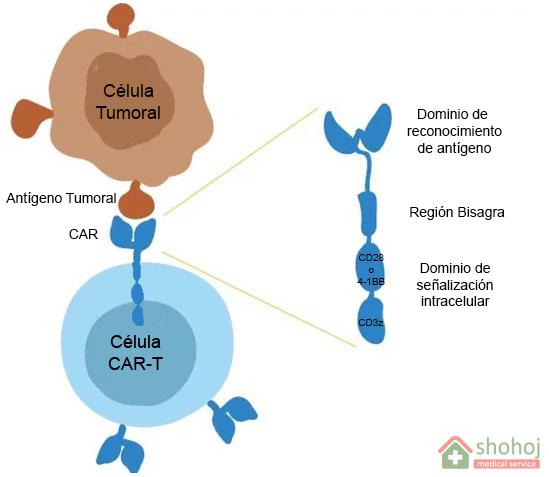
El primer componente de este tratamiento es el CAR, acrónimo de chimeric antigen receptor o receptor quimérico de antígeno. CAR es un receptor, es decir, una proteína que puede unirse e interaccionar con otras moléculas. Además, es quimérico, porque al igual que la Quimera de Arezzo, está formada por partes de origen distinta (en este caso, proteínas unidas mediante técnicas de ingeniería genética en el laboratorio). Y finalmente es de antígeno porque ese receptor reconoce antígenos tumorales, es decir, moléculas que están presentes en la superficie de las células tumorales.

Cuando expresamos estos receptores artificiales en la membrana de los linfocitos o células T, entre cuyas funciones naturales se encuentra la destrucción de células tumorales, obtendríamos el CAR-T. Estos están formado por tres regiones o dominios que nos permiten explicar su funcionamiento:
- Dominio de reconocimiento de antígeno. Es la parte que se encuentra fuera del linfocito y que puede unirse al antígeno tumoral. Como los distintos tumores pueden presentar antígenos diferentes, el CAR puede construirse para un tipo concreto de cáncer. Por ejemplo, en el tratamiento de algunos tipos de linfomas y leucemias el CAR reconoce la molécula CD19; en mieloma múltiple lo hace con BCMA, etc.
- Región bisagra: Es la porción que une el receptor CAR a la célula T.
- Dominio de señalización intracelular: Es la región que queda en el interior del linfocito T y está formada por la combinación de distintas moléculas que son capaces de activarlos como CD3z, CD28 o 4-1BB.
De esta manera, cuando la célula CAR-T entra en contacto con una célula tumoral, su receptor se unirá al tumor y activará al linfocito T para actuar contra ella y destruirla.
¿Cómo se obtienen y administran al paciente?
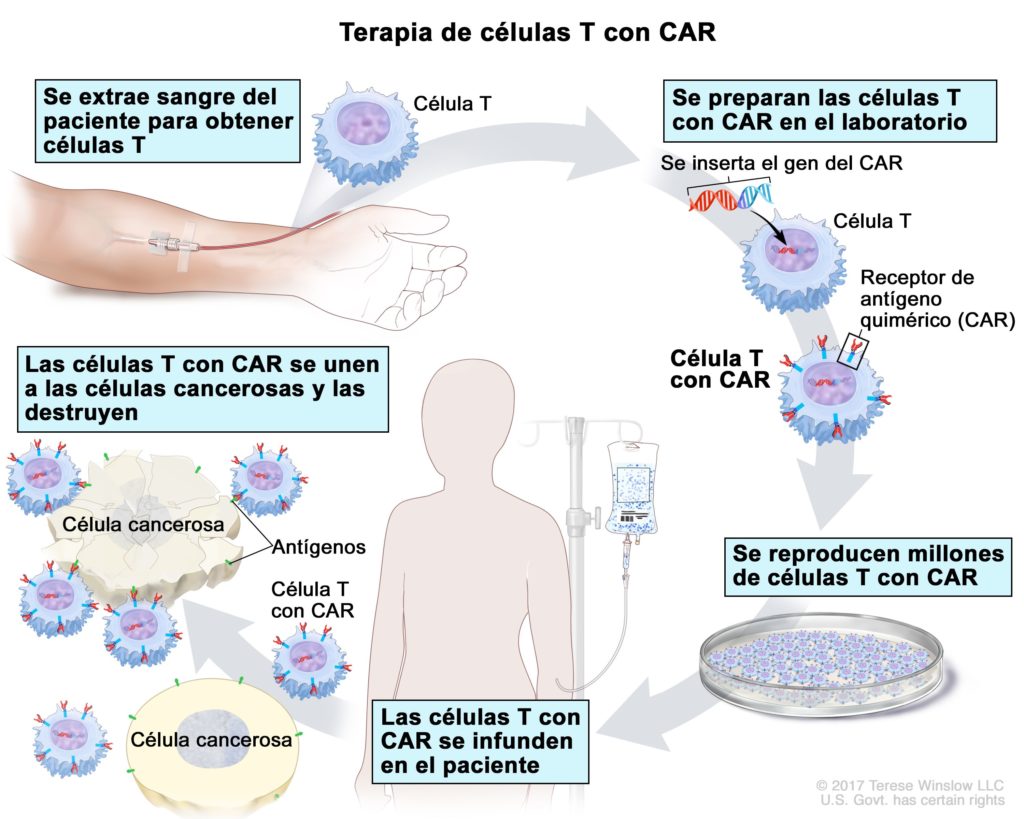
Si el diseño y la construcción de las células CAR puede parecernos muy compleja, el procedimiento para administrarlos a los pacientes tampoco se queda corto.
En primer lugar, se extraen los propios linfocitos T del paciente en un proceso conocido como aféresis. Estos linfocitos se envían a laboratorios dónde se modifican para introducir el gen que producirá el receptor CAR y se hacen crecer para conseguir millones de células. Este nuevo “producto” regresa al Hospital, dónde se devuelven o infunden al paciente para que luchen contra el tumor.
¿Entendéis ahora porqué Jose Antonio se sentía como un X-Men?
Con este procedimiento se han conseguido grandes resultados en el tratamiento de algunos tumores. Por ejemplo, no existía ningún tratamiento estándar pacientes con linfoma difuso de células B grandes que hubieses recaído a los tratamientos estándar. Sólo el 7% de estos pacientes conseguían curarse y su supervivencia media era de 6 meses. Pero cuando se les administró la terapia con células CAR-T se logró que hasta el 90% de ellos respondieran.
Tratamientos CAR-T disponibles
Desde 2017 las principales agencias reguladoras del medicamento ya han aprobado la comercialización de 5 tipos de células CAR-T para distintos tumores. Pero son muchos los que se encuentran en ensayos clínicos o en fase de investigación.
| Producto | Nombre Comercial | Fabricante | Antígeno | Dominio de señalización | Indicaciones |
| Tisagenlecleucel | Kymriah® | Novartis | CD19 | CD3z 4-1BB | Leucemia Linfoma |
| Axicabtagene ciloleucel | Yescarta® | Kite | CD19 | CD3z CD28 | Linfoma |
| Brexucabtagene ciloleucel | Tecartus® | Kite | CD19 | CD3z CD28 | Linfoma |
| Lisocabtagene maraleucel | Breyanzi® | Bristol-Myers Squibb | CD19 | CD3z 4-1BB | Linfoma |
| Idecabtagene vicleucel | Abecma® | Bristol-Myers Squibb y bluebird bio | BCMA | CD3z 4-1BB | Mieloma múltiple |
Limitaciones de las células CAR-T
Pese a estos grandes resultados las terapias CAR-T, al igual que cualquier otro tratamiento del cáncer, tienen una serie de inconvenientes:
- Precio: Debido a la gran complejidad de la terapia, los precios de estos tratamientos se aproxima a los 300.000 € por paciente. Una posible solución a esto sería la promoción de CAR-T académicos frente a los industriales que os acabo de presentar. Los CAR-T académicos son aquellos que desarrollan e impulsan desde un hospital universitario o público, como lo ha hecho el Hospital Clinic de Barcelona un 80% más barato.
- Toxicidad. El principal efecto secundario de este tratamiento es el síndrome de liberación de citoquinas. Como las células CAR-T se multiplica, puede secretar grandes cantidades de citoquinas, unas moléculas que estimulan al sistema inmune provocando fiebre, náuseas, dolor de cabeza… En algunos casos, también pueden producirse problemas en el sistema nervioso.
- Tumores sólidos: Como os he presentado, las célula CAR-T funcionan bien en tumores hematológicos, pero en tumores sólidos (como cáncer de mama, hígado o pulmón) se ha visto que pronto pierden su capacidad de atacar al cáncer y dejan de ser efectivos. Sin embargo, son muchas las líneas de investigación abiertas para intentar buscar una solución.
Ejemplo de #SinCienciaNoHayFuturo
He comenzado este post entrecomillando lo de “nuevo tratamiento” que nos decían los medios. Lo he hecho porque esta terapia se lleva investigando desde finales de los años 80s cuando el equipo de Zelig Eshhar, del Instituto Weizmann de Ciencias de Israel, desarrolló los primeros receptores quiméricos de células T. Y es mucho el trabajo realizado en laboratorios de todo el mundo hasta llegar a su aplicación en los pacientes.
Es, por tanto, un ejemplo más de que la inversión en ciencia hoy puede ser la garantía de la solución a los problemas de mañana y de un futuro mejor.
Muchas gracias por leernos, y nos vemos pronto.