Es bien conocido que desde la revolución industrial el aumento de CO2 en la atmósfera no ha parado de crecer debido a las actividades humanas, fundamentalmente la quema de combustibles fósiles como el carbón y los hidrocarburos. Los efectos de este aumento de concentración de dióxido de carbono en la atmósfera están de actualidad, fundamentalmente por las implicaciones que generan sobre el aumento de la temperatura global y la modificación del clima.
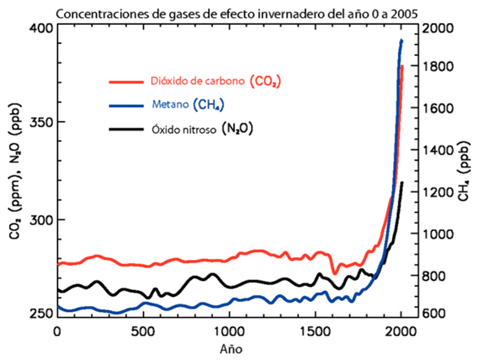
Pero el aumento del CO2 atmosférico tiene otras implicaciones que no están en primera plana de los medios, y que tienen y tendrán consecuencias importantes en el campo de la ciencia. Hoy vamos a ver, como este incremento está haciendo que nuestro mejor reloj para medir los tiempos pasados se esté desajustando; me refiero a la datación de los restos fósiles mediante la técnica del Carbono 14
Seguro que os suena esto de la datación por el Carbono 14, que lo habréis oído en muchas revistas científicas y muchas pelis, sobre todo de arqueología y antropología, pero ¿qué es y en que se fundamenta este método para averiguar la edad de un resto fósil que hace años fue un ser vivo? y , ¿por qué se está desajustando?
Nada más sabroso para ciencia carbónica que hablar del elemento al que debe su nombre: EL CARBONO, y en particular de su isótopo el Carbono 14 (14C), del que veremos su importancia para determinar la edad de los restos fósiles que algún día tuvieron vida.
El carbono (C) tiene número atómico 6. Esto significa que tiene seis protones en el núcleo e igual número de electrones en su corteza. Además de estos protones y electrones, los núcleos de los átomos contienen neutrones. El número de estos neutrones da lugar a los distintos isótopos del carbono.
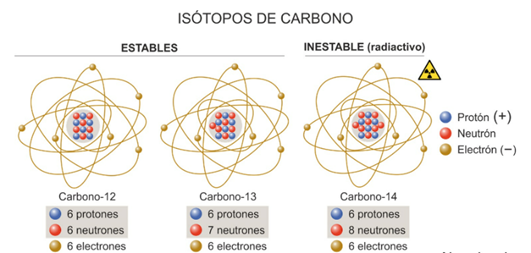
El 14C que tiene 8 neutrones, es muy inestable y se desintegra continuamente, pero también se forma de manera continua en la alta atmósfera por interacción de la radiación cósmica con 14N, el componente mayoritario del aire. Cuando la formación de 14C y su desaparición por desintegración se igualan, se dice que el isótopo está en equilibrio, y es lo que ha ocurrido en la naturaleza después de transcurridos miles de millones de años desde la formación del planeta.
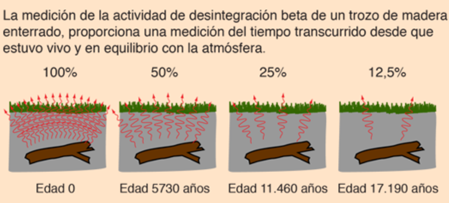
El ritmo de desintegración, que se conoce como vida media o período de semidesintegración es de 5.730 años, que es tiempo necesario para que cualquier cantidad de 14C se reduzca a la mitad.
El carbono es el elemento clave de todos los organismos vivos; construye la estructura de proteínas, carbohidratos y grasas. Está presente en la atmósfera como dióxido de carbono (CO2). Los seres vivos asimilan los tres isótopos de carbono (12C, 13C y 14C) continuamente: el proceso de fotosíntesis incorpora el átomo radiactivo en las plantas, de manera que la proporción 14C/12C en éstas, es similar al atmosférico. Los animales incorporan, por ingestión, el carbono de las plantas o de otros animales, por lo que su contenido en 14C también permanece en equilibrio con el atmosférico.
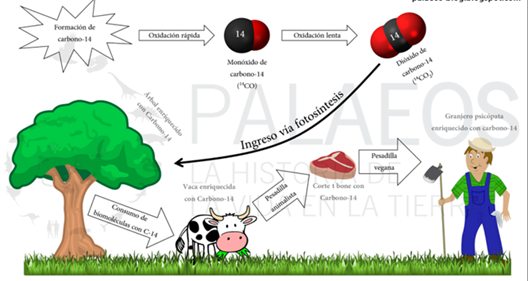
El “reloj de carbono 14” comienza a trabajar tan pronto cuando el animal o vegetal muere. El dióxido de carbono que contiene 12C, 13C y 14C radiactivo, penetra en todos los seres mientras están vivos y participan en el ciclo de intercambio con la biosfera, pero esto cambia cuando el organismo muere. Cuando un organismo muere, ya no absorbe carbono, por lo que su cantidad de 12C permanece constante, pero la cantidad de 14C disminuye constantemente por la desintegración. La relación 14C/12C comienza a decrecer. Como sabemos que el decaimiento del 14C es a la mitad cada 5730 años, determinando la diferencia de la relación 14C/12C que tiene en la actualidad el fósil, con el contenido estándar 14C/12C de la biosfera, podemos conocer la fecha de su muerte.
Fue el profesor de química de Chicago, Willard Libby, quien, conociendo la existencia del radiocarbono, planteó en 1945, la revolucionaria idea de utilizarlo para realizar la datación de la materia orgánica. En sus investigaciones, Libby estudiaba la presencia de carbono 14 en los restos geológicos a través de la quema de una muestra tras limpiarla de impurezas. Así provocaba que todo el carbono del objeto de estudio se convirtiera en CO2. El dióxido de carbono obtenido era purificado y se medía su radiactividad para conocer la cantidad de 14C, y por tanto la proporción de 14C/12C, y compararla con el estándar de la biosfera, conociendo así la antigüedad de la muestra. Por estos estudios recibió el Nobel de Química de 1960.

CONCLUSIONES
Pero ¿por qué os cuento todo esto?, si es una técnica que viene utilizándose desde mediados del siglo pasado.
Primero para que refresquéis vuestros conocimientos de química, segundo para que veáis como los isótopos radiactivos son de gran utilidad en nuestra vida y, por último, la CARBONOTICIA es, que estamos desvirtuando este magnífico método de datación, debido a las actividades industriales humanas.
El CO2 que emitimos de la quema de combustibles fósiles, aunque procede de materia orgánica, ésta es tan antigua, que prácticamente no tiene 14C por haberse desintegrado, por lo que el CO2 emitido por su combustión solo contiene 12C, con lo que estamos diluyendo la relación natural del 14C/12C y alterando el estándar que utilizamos para la comparación.
Es decir que la relación natural del 14C/12C en la atmósfera en la que vivieron los faraones egipcios y que éstos asimilaron durante sus vidas, no es la misma relación que la atmósfera actual en la que vivimos nosotros, ni será la misma en el futuro, dentro de cientos o miles de años; por lo que para datar correctamente un resto fósil , no solo habrá que medir la relación 14C/12C de la muestra, sino también conocer qué relación tenía la atmósfera en la que vivió, y este último dato que hasta ahora se suponía constante, es el que estamos desvirtuando por las emisiones de CO2 de la quema de combustibles fósiles.
Todo esto supone que tendremos que estar ajustando continuamente el estándar de comparación, y supondrá una problemática para la datación en milenios posteriores, cuando la cantidad de dióxido de carbono emitida sea tal, que no permita la correcta datación.
Bibiografía
https://geolodiaavila.com/2019/04/03/metodo-de-datacion-por-radiocarbono-o-carbono-14/
https://www.uv.es/gidprl/c14/index.html
https://www.xlsemanal.com/conocer/ciencia/20180303/la-prueba-del-carbono-14-amenazada.html

Buenísima entrada. Muy entretenida, nos refrescas la química y pones sobre la mesa un problema a mayores de las emisiones del dióxido de carbono